Niels Bohr atommodellje szerint az atom protonjai és neutronjai a magban vannak, míg az elektronok körülötte vannak. Bár nem tudhatjuk, hol van pontosan egy elektron, vannak olyan területek, ahol a legnagyobb valószínűséggel megtalálható, az atomi pályák. És hogyan tudjuk meghatározni ezeket a pályákat? Nagyon egyszerű, kvantumszámokkal.
Mik a kvantumszámok?
4 kvantumszám létezik. Közülük hárman adnak információt arról, hogy hol található egy adott atom elektronja, vagyis információt adnak a pályáról. Másrészt a negyedik kvantumszám nem azt mondja meg, hol van az elektron, hanem azt, hogy hogyan. Még mindig nem vagy túl világos ebben? Hajrá!
- Fő kvantumszám (n). Ez az utolsó feltöltött energiaszint, és jelzi a pálya méretét, és ezért a mag és az elektron közötti távolságot. Miért? Nagyon könnyű. Minél nagyobb a pálya, annál távolabb lehet az elektron az atommagjától.
- Azimutális vagy másodlagos kvantumszám (l). Adja meg a pálya alakját.
- Mágneses kvantumszám (m). Az orbitális tájolását jelzi.
- Spin kvantumszám (ok). Mondja meg, hogy az elektron milyen irányban forog.
Könnyű igaz? Menjünk a fontos dologhoz!
Hogyan származnak a kvantumszámok?
A kvantumszámok megszerzéséhez csak 2 egyszerű lépést kell követnie:
- Írja fel az elektronkonfigurációt.
- Szerezze meg a kvantumszámokat a differenciál elektronból (az utolsó, amely kitölti a pályát).
Elektronikus konfiguráció
Kezdjük az 1. lépéssel, írjuk be az elektronkonfigurációt. Hogyan? Két módszer létezik erre, térjünk rá!
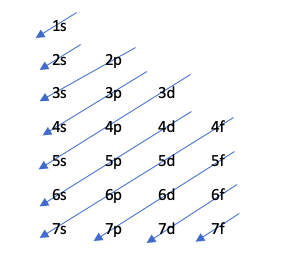
Moeller diagram
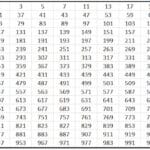
Ez a technika az alábbi rajz alapján jelzi a pályák kitöltésének sorrendjét:
Ezt a diagramot az Aufbau -elv szabályozza, amely azt védi, hogy a pályák növekvő energiarendben töltsenek ki, vagyis az a pálya, amelyik a legkevesebb energiával rendelkezik, korábban kitelik.
Ha meg szeretné tudni, hogy melyik pályának van több energiája, hajtsa végre az n + l műveletet. Ha ez a művelet két különböző atom esetében ugyanazt a számot eredményezi, akkor annak, amelynek n száma nagyobb, több energiája lesz. Más szóval, döntetlen esetén először a legalacsonyabb n -es számot kell kitölteni. Nézzük egy példával:
4p: n + l -> 4 + 1 = 5
5s: n + l -> 5 + 0 = 5
Mivel az n + l szabályban döntetlen van, 4p -t tölt ki korábban, mert n száma alacsonyabb.
Kernel modell
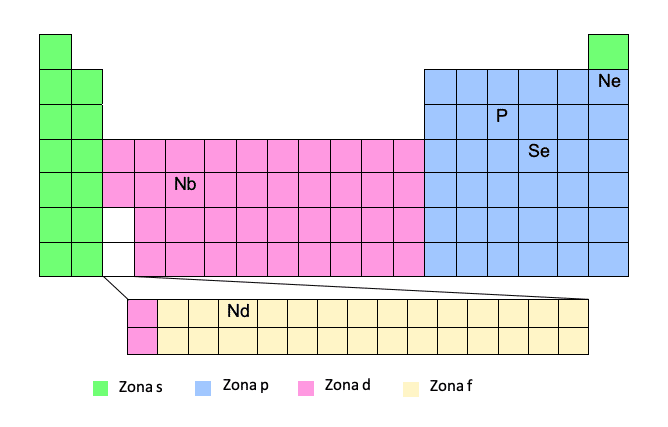
Ahhoz, hogy a modell szerinti elektronikus konfigurációt megkapja, nagyon jól ismernie kell a periódusos rendszert. Ha megvan a táblázatban az elem atomszáma és helyzete, akkor ez egy tortaszelet!
Ez a módszer egyszerűsített módszernek tekinthető, mivel lehetővé teszi, hogy ne kelljen a teljes elektronkonfigurációt írni. Ily módon zárójelbe írhatjuk a fenti nemesgáz elem nevét, majd az adott nemesgáz útját a kérdéses elemhez. Lássunk egy példát:Így a pályát a periódus számának (a periódusos rendszer sora) és a "zóna" figyelembevételével írjuk le, és az elektronikus konfiguráció megírása után kivonjuk a kvantumszámokat.
A foszfor (P) az előző nemesgázból, azaz a neonból lesz írva:
P -> [Ne] 3s23p3
Természetesen óvatosnak kell lennie ezzel a módszerrel, mivel a d és f zónák speciális zónák. Az utazás során a d zónába nem az időszak (sor) számát, hanem az időszak számát mínusz egybe tesszük. Ugyanez történik az F területtel is, nem az időszak számát, hanem az időszak számát mínusz kettőt adjuk meg. Pár példával jobban megérted a dolgot:
Nb -> [Kr] 5s14d4
Bár az 5. időszakban van, amikor a d zónában vagyunk, kivonunk 1 -et.
Nd -> [Xe] 6s24f14
Bár a 6. időszakban van, amikor az f zónában vagyunk, kivonjuk a 2 -t.
Kivételek az elektronikus konfigurációban
Az elektronkonfigurációnak van néhány speciális aspektusa, amelyek, ha nem ismerik őket, nagy fejadagolókhoz vezethetnek. De ne terjesszen pánikot! Elmondjuk!
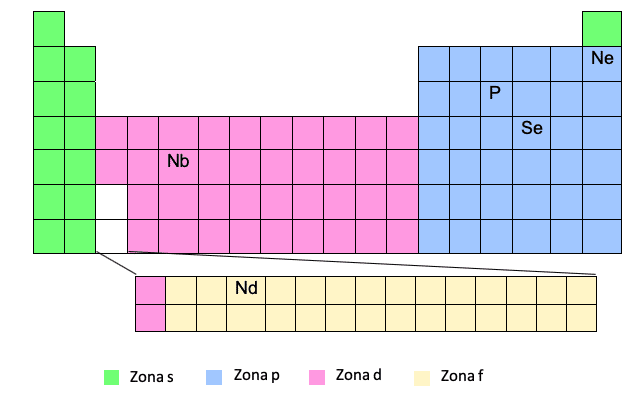
F zóna
Az F zóna megjelenik a periódusos rendszer alján, de valójában "beágyazva" van a fehérben látott résbe, vagyis a D zóna utolsó két sorának első és második eleme közé.
Látod? Ezért néha, amikor meg kell írnunk egy elem elektronikus konfigurációját az F zónában, például Nd, akkor egy elektronot kell a megfelelő szintű D zónába helyeznünk a D zónában lévő elemre való hivatkozással, amely a belépés előtt van F zóna.
Ce -> [Xe] 6s25d14f1
6. és 11. csoport
A 6. és 11. csoport átmeneti fémek utolsó héjában 4, illetve 9 elektron található. Ezért, hogy stabilabb elem legyen, az s pálya izgatott lesz, és elveszít egy elektronot, amely átmegy a következő pályára, a d. Ily módon az s pálya elektronnal marad; és d 5 -tel, ha a 6. csoport eleme, vagy 10 -el, ha a 11. csoport eleme.
Íme egy példa:
Ag -> [Kr] 5s24d9
Nyilvánvalóan ez lenne az ezüst (Ag) elektronkonfigurációja. Amikor azonban elveszítünk egy elektronot az s pályáról, ez így néz ki:
Ag -> [Kr] 5s14d10
Vannak azonban kivételek e szabály alól, például a volfrám (6. csoport), amely 2 elektrondal marad az s orbitálison és 4 a d orbitálison.
De ne aggódjon! A legjellemzőbbek (Cr, Cu, Ag és Au) követik ezt a szabályt.
Érted? Jól. Ennyit kell tudni az elektronok konfigurálásáról. Nézzük a kvantumszámokat!
Hogyan szerezzünk kvantumszámokat
Ahhoz, hogy megkapjuk a kvantumszámokat, tudnunk kell, hogy hány elektron fér el az egyes orbitális héjakban, figyelembe véve, hogy 2 elektron fér el egy pályán.
- Réteg s. Csak egy pályája van, így 2 elektronot képes befogadni.
- Réteg p. 3 pályája van, tehát 6 elektronnak van helye.
- D réteg. 5 pályája van, így 10 elektron fér el.
- F réteg. 7 pályája van, vagyis 14 elektronot tartalmaz.
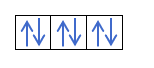
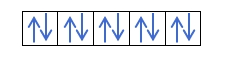
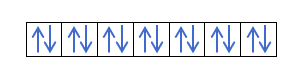
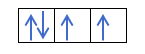
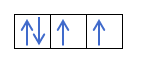
Most, hogy megértette, hogy minden pályán 2 elektron van, ismernie kell Hund szabályát. Ez a szabály azt mondja, hogy az azonos alszintű vagy héjú pályák, például a p héj kitöltésekor az elektronok az egyik irányba (pozitív), majd a másikba (negatív) töltik ki a pályát. Szeretné látni egy példával?
Ha van 2p4, azaz a 2p pálya 4 elektronnal nem fog így kitölteni:
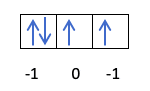
Így fog kitölteni:
Megkapod? Remek, nézzük meg, hogyan kell kiszámítani a számokat:
- N kvantumszám. Ez a szám egybeesik az elektronkonfiguráció utolsó szintjének számával. Például, ha az elektronkonfiguráció 4 másodpercben végződik2, a fő kvantumszám 4 lesz.
- Kvantumszám l. Ez a szám az utoljára kitöltött rétegtől függ.
- S réteg -> l = 0
- P réteg -> l = 1
- D réteg -> l = 2
- F réteg -> l = 3
- M kvantumszám. Az m szám tetszőleges érték lehet -l és + l között, tehát attól függ, hogy a differenciálelektron milyen alszinttel rendelkezik, vagyis attól, hogy s, p, d vagy f. Ennek a számnak a kiszámítása egy kicsit bonyolultabb, nézzük meg néhány rajzzal:
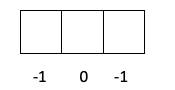
- S réteg -> Amint láttuk, az l 0 -t ér, tehát az m csak 0 -t érhet.
- P réteg -> Az l értéke 1, tehát m lehet -1, 0 vagy 1.
- D réteg -> Az l 2, tehát m lehet -2, -1, 0, 1 és 2.
- Az f -> l réteg értéke 3, tehát m lehet -3, -2, -1, 0, 1, 2 és 3.
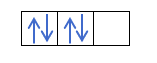
Már tudja, hogyan töltődnek ki a pályák, így az m kvantumszámnak meg kell adni annak a lyuknak az értékét, ahol az utoljára húzott elektron található. Emlékszel erre a korábbi példára?
Ebben az esetben az m -1 lesz, mivel a p héjban (3 pálya), ha 4 elektron van, az utoljára kitöltendő az első pálya negatívja lenne.
- S kvantumszám. Az s kvantumszám csak ½ és -½ lehet. Ha az utolsó rajzolt elektron pozitív, azaz a nyíl felfelé van, akkor az s ½ lesz. Másrészt, ha az utolsó elektron, amely kitölti a pályát, negatív, azaz a nyíl lefelé mutat, az s -½ lesz.
Gyakorlatok és példák
Igen, már tudjuk, hogy mindez sok információ, de néhány példával jobban megérti. Essünk neki!
Példa 1
Szelén (Se) -> Atomszám: 34
- Megírjuk az elektronkonfigurációt. Az elektronkonfigurációt a Moeller -diagram szerint írjuk, figyelembe véve, hogy az s, p, d és f pályákon 2, 6, 10 és 14 elektron van. A konfigurációt az elektronok számának hozzáadásával írjuk, ami kitevőként van írva.
1s22s22p63s23p64s23d104p4
Mivel a 4p pálya nem töltődik fel, mivel az elektronok összeadódnak 36 -tal, ezért nem teszünk 4p -t6de 4p4.
- Kivesszük a kvantumszámokat. Ehhez megnézzük a vegyérték- vagy differenciál elektronot, vagyis az utolsó elektronot, amely kitöltötte a pályát. Ebben az esetben a 4p -t nézzük4.
- Fő kvantumszám. Az utolsó feltöltött energiaszint 4 volt.
n = 4
- Másodlagos kvantumszám. Az utolsó energia -alszint, amelyet kitöltött, a p pálya volt.
l = 1
- Mágneses kvantumszám. Ha az elektronokat rajzoljuk, az utoljára kitöltendő a p héj első pályája lesz.
m = -1
- Spin kvantumszám. Az utolsó elektron, amely elfoglalja a p pályát, a lefelé mutató nyíllal rendelkezik.
s = -½
Példa 2
Arany (Au) -> [Xe] 6s14f145d10
- Fő kvantumszám -> n = 5
- Másodlagos kvantumszám -> l = 2
- Mágneses kvantumszám -> m = 2
- Spin kvantumszám -> s = -½
És ennyi! Most rajtad a sor, elvégezheted az elektronkonfigurációt és megkaphatod a következő elemek kvantumszámát?:
Cr(24), Rb(37), Br(35), Lu(71), Au(79)