De acordo com o modelo atômico de Niels Bohr, os prótons e nêutrons de um átomo estão no núcleo, enquanto os elétrons estão ao seu redor. Embora não possamos saber onde um elétron está exatamente, há áreas onde é mais provável que ele seja encontrado, os orbitais atômicos. E como podemos determinar esses orbitais? Muito simples, usando números quânticos.
Quais são os números quânticos?
Existem 4 números quânticos. Três deles nos dão informações sobre a localização de um elétron de um determinado átomo, ou seja, nos dão informações sobre o orbital. Por outro lado, o quarto número quântico não nos diz onde está o elétron, mas como. Você ainda não está muito claro sobre isso? Vá em frente!
- Número quântico principal (n). É o último nível de energia a ser preenchido e indica o tamanho do orbital e, portanto, a distância entre o núcleo e o elétron. Porque? Muito simples. Quanto maior o orbital, mais distante o elétron pode estar do núcleo do átomo.
- Número quântico azimutal ou secundário (eu). Indique a forma do orbital.
- Número quântico magnético (m). Indica a orientação do orbital.
- Número quântico de spin (s). Diga para que lado o elétron gira.
Fácil, certo? Vamos com o que é importante!
Como os números quânticos são derivados
Para obter os números quânticos, basta seguir 2 passos simples:
- Escreva a configuração do elétron.
- Obtenha os números quânticos do elétron diferencial (o último que preenche o orbital).
Configuração eletronica
Começamos com a etapa 1, escrever a configuração do elétron. Como? Existem dois métodos para fazer isso, vamos lá!
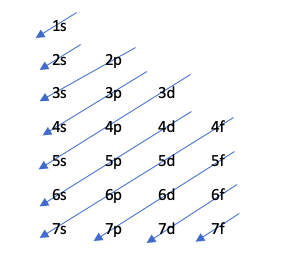
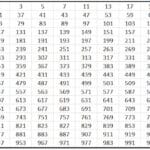
Diagrama de Moeller
Esta técnica indica a ordem de preenchimento dos orbitais através do seguinte desenho:
Este diagrama é regido pelo princípio de Aufbau, que defende que os orbitais se preencham em ordem crescente de energia, ou seja, o orbital que tiver menos energia será preenchido antes.
Para descobrir qual orbital tem mais energia, a operação n + l é realizada. Se esta operação para dois átomos diferentes resultar no mesmo número, aquele cujo número n é maior terá mais energia. Ou seja, em caso de empate, aquele com o menor número n é preenchido primeiro. Vamos ver com um exemplo:
4p: n + l -> 4 + 1 = 5
5s: n + l -> 5 + 0 = 5
Como há um empate na regra n + l, ela preenche 4p antes porque seu número n é menor.
Modelo do kernel
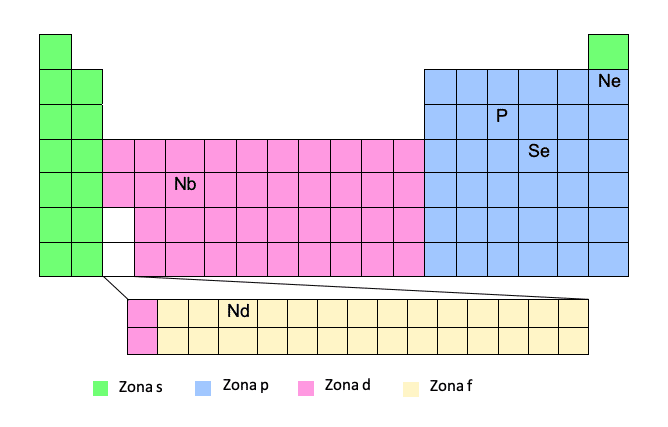
Para obter a configuração eletrônica seguindo este modelo você deve conhecer muito bem a tabela periódica. Se tivermos o número atômico e a posição do elemento na tabela, é moleza!
Este método é considerado um método simplificado, pois permite não ter que escrever a configuração eletrônica completa. Desta forma, podemos escrever o nome do elemento de gás nobre acima entre parênteses e, em seguida, o caminho desse gás nobre até o elemento em questão. Vejamos um exemplo:Assim, escreveremos a trajetória levando em consideração o número do período (linha da tabela periódica) e a "zona" e, uma vez escrita a configuração eletrônica, extrairemos os números quânticos.
O fósforo (P) será escrito do gás nobre anterior, ou seja, o néon:
P -> [Ne] 3s23p3
Claro, você deve ter cuidado com este método, uma vez que as zonas d e f são zonas especiais. À medida que fazemos a viagem, na zona d não colocaremos o número do período (linha), mas o número do período menos um. O mesmo acontece com a área F, não colocaremos o número do período, mas o número do período menos dois. Você entenderá isso melhor com alguns exemplos:
Nb -> [Kr] 5s14d4
Embora seja no período 5, quando estamos na zona d, subtraímos 1.
Nd -> [Xe] 6s24f14
Embora seja no período 6, quando estamos na zona f, subtraímos 2.
Exceções na configuração eletrônica
A configuração do elétron tem alguns aspectos especiais que, se você não estiver ciente deles, podem levar a grandes alimentadores de cabeçote. Mas não espalhe o pânico! Nós vamos te contar!
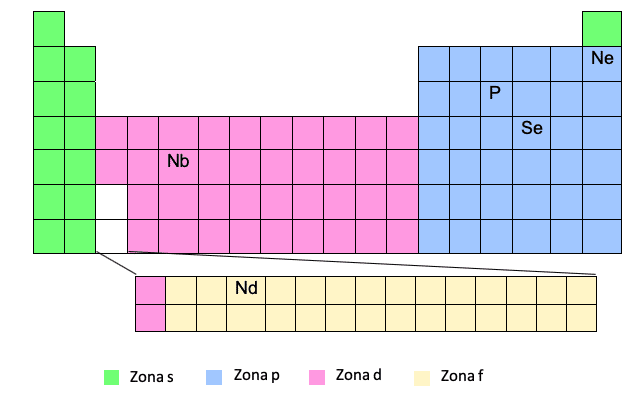
Zona F
A zona F aparece na parte inferior da tabela periódica, mas na verdade está "embutida" na lacuna que vemos em branco, ou seja, entre o primeiro e o segundo elemento das duas últimas linhas da zona D.
Você vê? Portanto, às vezes, quando temos que escrever a configuração eletrônica de um elemento na zona F, por exemplo, Nd, teremos que colocar um elétron na zona D do nível correspondente em referência a esse elemento na zona D que está antes de entrar zona F.
Ce -> [Xe] 6s25d14f1
Grupo 6 e Grupo 11
Os metais de transição do grupo 6 e do grupo 11 têm 4 e 9 elétrons em suas últimas camadas, respectivamente. Portanto, por ser um elemento mais estável, o orbital s fica excitado e perde um elétron, que passa para o próximo orbital, o d. Dessa forma, o orbital s ficará com um elétron; ed com 5, se for um elemento do grupo 6, ou com 10, se for um elemento do grupo 11.
Aqui está um exemplo:
Ag -> [Kr] 5s24d9
Aparentemente, essa seria a configuração eletrônica da prata (Ag). No entanto, perdendo um elétron do orbital s, fica assim:
Ag -> [Kr] 5s14d10
No entanto, há exceções a essa regra, como Tungstênio (grupo 6), que fica com 2 elétrons no orbital s e 4 no orbital d.
Mas não se preocupe, os mais típicos (Cr, Cu, Ag e Au) seguem esta regra.
Você entendeu? Nós vamos. Isso é tudo que você precisa saber sobre a configuração do elétron. Vamos buscar os números quânticos!
Como obter números quânticos
Para obter os números quânticos, devemos saber quantos elétrons cabem em cada camada orbital, levando em consideração que 2 elétrons cabem em um orbital.
- Camadas. Ele tem apenas um orbital, então pode conter 2 elétrons.
- Camada p. Ele tem 3 orbitais, então há espaço para 6 elétrons.
- Camada d. Ele tem 5 orbitais, então pode conter 10 elétrons.
- Camada f. Possui 7 orbitais, ou seja, pode conter 14 elétrons.
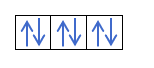
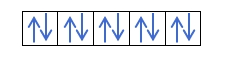
Agora que você entende que existem 2 elétrons em cada orbital, você deve conhecer a regra de Hund. Essa regra diz que ao preencher orbitais do mesmo subnível ou camada, por exemplo, a camada p, os elétrons preenchem o orbital em uma direção (positiva) e depois na outra (negativa). Quer ver com um exemplo?
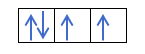
Se tivermos 2p4, ou seja, o orbital 2p com 4 elétrons não se preencherá assim:
Será preenchido assim:
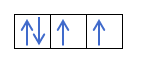
Você está entendendo? Ótimo! Vamos ver como calcular os números:
- Número quântico n. Este número coincide com o número do último nível da configuração eletrônica. Por exemplo, se a configuração eletrônica termina em 4s2, o número quântico principal será 4.
- Número quântico l. Este número depende da última camada que foi preenchida.
- Camada s -> l = 0
- Camada p -> l = 1
- Camada d -> l = 2
- Camada f -> l = 3
- Número quântico m. O número m pode ser qualquer valor entre -l a + l, então dependerá do subnível em que o elétron diferencial está, ou seja, se é s, p, d ou f. Como calcular esse número é um pouco mais complicado, vamos ver com alguns desenhos:
- Camada s -> Como vimos, l vale 0, então m só pode valer 0.
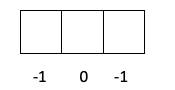
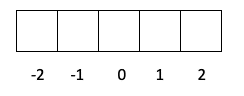
- Camada p -> O l vale 1, então om pode ser -1, 0 ou 1.
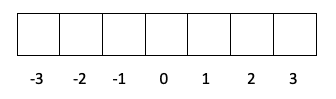
- Camada d -> O l é 2, então om poderia ser -2, -1, 0, 1 e 2.
- A camada f -> l vale 3, então m pode ser -3, -2, -1, 0, 1, 2 e 3.
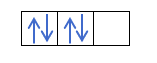
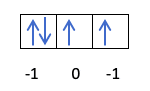
Você já sabe como os orbitais são preenchidos, então o número quântico m terá o valor do buraco onde está o último elétron desenhado. Você se lembra deste exemplo anterior?:
Nesse caso, om será -1, pois na camada p (3 orbitais), se houver 4 elétrons, o último a preencher seria o negativo do primeiro orbital.
- Números quânticos. O número quântico s pode valer apenas ½ e ½. Se o último elétron desenhado for positivo, ou seja, a seta para cima, o s será ½. Por outro lado, se o último elétron que preencheu o orbital for negativo, ou seja, com a seta apontando para baixo, o s será -½.
Exercícios e exemplos
Sim, já sabemos que tudo isso é muita informação, mas você vai entender melhor com alguns exemplos. Vamos la!
1 exemplo
Selênio (Se) -> Número atômico: 34
- Escrevemos a configuração do elétron. Estamos escrevendo a configuração eletrônica de acordo com o diagrama de Moeller, levando em consideração que os orbitais s, p, de f têm 2, 6, 10 e 14 elétrons respectivamente. Estamos escrevendo a configuração adicionando o número de elétrons, que é escrito como um expoente.
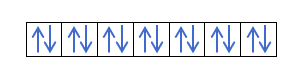
1s22s22p63s23p64s23d104p4
Como o orbital 4p não se enche, já que os elétrons somariam 36, não colocamos 4p6mas 4p4.
- Tiramos os números quânticos. Para fazer isso, olhamos para a valência ou elétron diferencial, ou seja, o último elétron que preencheu o orbital. Neste caso, vamos olhar para 4p4.
- Número quântico principal. O último nível de energia a ser preenchido foi 4.
n = 4
- Número quântico secundário. O último subnível de energia a preencher foi o orbital p.
l = 1
- Número quântico magnético. Se estivermos atraindo os elétrons, o último a preencher será o primeiro orbital da camada p.
m = -1
- Número quântico de spin. O último elétron a ocupar o orbital p possui a seta para baixo.
s = -½
2 exemplo
Ouro (Au) -> [Xe] 6s14f145d10
- Número quântico principal -> n = 5
- Número quântico secundário -> l = 2
- Número quântico magnético -> m = 2
- Número quântico de spin -> s = -½
E isso é tudo! Agora é sua vez, você poderia fazer a configuração do elétron e obter os números quânticos dos seguintes elementos?:
Cr(24), Rb(37), Br(35), Lu(71), Au(79)